Aunque este fenómeno es muy frecuente en Química orgánica, no es exclusiva de ésta pues también la presentan algunos compuestos inorgánicos, como los compuestos de los metales de transición.
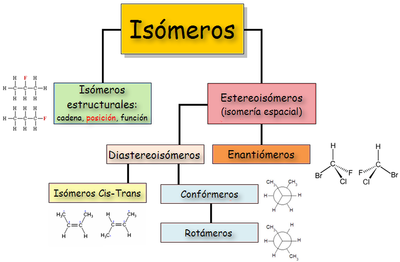
Tambien se podria decir que son compuestos que teniendo la misma fórmula molecular, presentan propiedades diferentes, debido a que presentan diferente fórmula estructural.

Isómeros estructurales:
Isómeros de cadena: estos isómeros se presentan en compuestos que difieren en la posición de los átomos en la cadena carbonada. Estos isómeros son característicos de los alcanos y cicloalcanos.
En la siguiente figura se observan isómeros de alcanos alifáticos:
Fórmula bruta: C4H10


En la siguiente figura se observan isómeros de alcanos cíclicos.
Fórmula bruta: C8H16
 |
 |
 |
Isómeros de posición: estos compuestos presentan la misma cadena o anillo y los mismos grupos funcionales, pero difieren en la posición o posiciones a las cuales están unidos esos grupos, por lo que las propiedades físicas e incluso las químicas varían
| Fórmula bruta: C4H9 (OH) | Fórmula bruta: C4H8 (OH) |
 |
 |
Isómeros de función: estos isómeros se distinguen por presentar grupos funcionales diferentes. Los isómeros se presentan entre compuestos diferentes tales como: dienos y alquinos, aquenos y cicloalcanos, aldehídos y cetonas, alcoholes y éteres, ácidos y ésteres, entre otros.
| Fórmula
bruta: C4H6 Alquino isómero de dieno |
Fórmula
bruta: C3H6 Alqueno isómero de cicloalcanos |
 |
Isómeros Espaciales:
Isómeros geométricos: en un compuesto orgánico la rotación alrededor de un enlace simple carbono-carbono es libre, esto permite que los átomos de dicho compuesto tomen posiciones relativas formando las denominadas conformaciones.
La diferencia energética para alcanzar una configuración u otra es muy pequeña apenas de 6 a 6 Kcal/mol, esto hace imposible asilar las diferentes conformaciones de los compuestos que presentan enlaces simples.
Cuando se trata de compuestos con doble enlace carbono-carbono, la rotación está restringida por la cantidad de energía. El doble enlace es rígido y sólo puede producirse si el doble enlace se rompe, para lo cual es necesario alrededor de 70 Kcal/mol.
Los isómeros geométricos contienen los mismos rasgos estructurales, los mismos grupos atómicos, los mismos ángulos de enlace y están unidos a las mismas posiciones en anillos idénticos o estructuras de cadenas idénticas, solo se diferencia en alguno de los grupos en el espacio, por lo que se les llama estereoisómeros.
Configuración CIS: esta configuración se presenta cuando grupos idénticos (hidrógenos, halógenos, etc.) aparecen en un mismo lado del plano que pasa por los dos carbonos por el doble enlace y es perpendicular al plano de la molécula.
EJERCICIOS
DE ISOMERÍA RESUELTOS
1) Fórmula un isómero de cadena del metil butadieno
La formula del metil butadieno
es: CH2=C-CH=CH2
׀
CH3
Un isómero de cadena es el que su
cadena principal tiene distinto número de átomos de Carbono. Así pues:
CH2=CH-CH=CH-CH3 1,3- Pentadieno
2) Considera los siguientes compuestos:
A) 4- Penten 2-ol B)
3- pentanona C) 2- pentanona D) Metil butanona
Escribe sus formulas e indica qué tipo de isomería
presentan entre sí: a- A y B; b- B y
C; c- C y D
A) CH3-CHOH-CH2-CH=CH2 B) CH3-CH2-CO-CH2-CH3
C)
CH3-CH2- CH2-CO-CH3 D) CH3-CH-CO-CH3
׀
CH3
A y B son isómeros
de función, la misma cadena con distintas funciones. B y C son isómeros de
posición, la misma cadena, con la misma función, pero en distinta posición. C y
D son isómeros de cadena, tienen distinta cadena principal, de diferente número
de carbonos.
3) ¿Posee el etanol algún isómero de posición? ¿Y el 1-
propanol?
El etanol o alcohol etílico, CH3-CH2OH,
no posee ningún isómero de posición ya que sus dos átomos de carbono son terminales
son equivalentes al poner localizadores, de forma que si el OH está unido al
que hemos escrito a la derecha habría que empezar a contar por él dándonos el
1- etanol, y si estuviera unido al de la izquierda, CH2OH-CH3,
habría que empezar a contar por la izquierda, dándonos también el 1- etanol. Es
decir, son el mismo compuesto, no dos diferentes, por ello al nombrarlo no es
necesario indicar el localizador de la función alcohol, se nombra simplemente
etanol o alcohol etílico.
El 1- propanol si posee un isómero
de posición, ya que los dos carbonos terminales no son equivalentes al carbono
central a la hora de poner localizadores. Por tanto, el 2- propanol, CH3-CHOH-CH3,
es un isómero de posición –la misma cadena, con la misma posición en distinta
posición- del 1- propanol, CH3-CH2-CH2OH.
4) La formula del Cloruro de etilo o Cloro etano en el
espacio es:
Dibuja su imagen especular (de espejo) ¿Es superponible
la molécula dada con su imagen especular? ¿Cómo tendría que ser el carbono para
que formarán una pareja de isómeros enantiómeros u ópticos?
La molécula dada si
puede superponerse con su imagen en el espejo. Por tanto, estas no son una
pareja de enantiómeros o isómeros ópticos, sino que son la misma molécula,
basta un giro adecuado para hacerlas coincidir.
Para que hubiera
isómeros ópticos o enantiómeros el carbono tendría que ser asimétrico, es
decir, sus cuatro enlaces realizados con distintos sustituyentes. En este caso
dos enlaces son realizados con el mismo, con H, luego el C no es asimétrico y
las imágenes se pueden superponer, con lo cual no son enantiómeros.
5) Explica por qué el 2- buteno posee isomería
geométrica, mientras que el 1-
buteno no.
Al desarrollar la
formula del 2- butano, CH3-CH=CH-CH3, podemos tener estas
dos estructuras:
Estos dos
compuestos son isómeros espaciales del tipo geométrico o Cis-Trans. Al isómero
que tiene los dos sustituyentes más voluminosos del mismo lado del eje del
doble enlace se le llama isómero Cis, y al que los tiene de distinto lado
isómero trans. Así pues el compuesto A es el Cis- 2- buteno y el compuesto B el
Trans- 2- butano.
En el caso del 1- butano
no hay isómeros geométricos, ya que para que haya isómeros geométricos, los dos
sustituyentes unidos a cada carbono del doble enlace deben ser distintos entre
sí, ya que de lo contrario con que uno de ellos sufra un giro de 180º respecto
al eje del doble enlace coincidirían, es decir son el mismo compuesto: